Nella coltivazione dell’anthurium bisogna porre molta attenzione alle sostanze nutritive e l’EC somministrati alle piante, ma non bisogna dimenticare che un altro parametro in cui dobbiamo porre la nostra attenzione è quello del pH dell’acqua di alimentazione. Perché? Qual è l’importanza del pH e in che modo influisce sulla pianta? Cerchiamo di capire qualcosa in più su questo importante valore.
Il valore del pH rappresenta il logaritmo negativo della concentrazione degli ioni idrogeno in una soluzione. Il pH costituisce quindi una misura per l’acidità. Quando il pH viene aumentato o abbassato di 1 punto, ciò significa che la soluzione diventa 10 volte più basica o acida. Ciò significa che un ph 4 è 1.000 volte più acido di un pH 7! Questo è il motivo per cui il pH riveste un ruolo così importante nelle nostre coltivazioni. Un’acqua troppo acida è dannosa per la pianta e per l’ambiente in cui si sviluppano le radici. In questo articolo analizzeremo ulteriormente questo aspetto.

pH dell’acqua somministrata
Nel substrato delle piante è presente di base un determinato pH. Per ottenere uno sviluppo ottimale dell’apparato radicale è importante che il pH del substrato e quello della radice non differiscano di molto. Si dovrà quindi cercare di modificare quanto meno possibile il valore del pH di entrambi quando somministreremo acqua. Mantenendolo stabile, la pianta potrà assorbire al meglio le sostanze nutritive.
L’assorbimento di sostanze nutritive da parte della pianta
Il pH svolge un ruolo importante nell’assorbimento di sostanze nutritive attraverso le radici. Quando il pH è troppo alto o troppo basso, le sostanze nutritive non possono essere assorbite in modo ottimale. Per le piante, un pH ideale della soluzione nutritiva è compreso tra 5 e 6. Quando il pH è superiore a 6, le piante possono avere problemi nell’assorbimento di boro, rame e fosfati. Inoltre, le sostanze tenderanno a precipitare prima quando il pH è elevato, e ciò può accadere sia nel contenitore dei fertilizzanti sia nella rete di tubature.
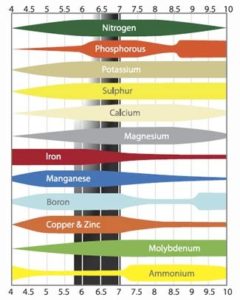
Quando il pH è troppo basso, inferiore a 5, la pianta ha di nuovo difficoltà ad assorbire altre sostanze. Il problema maggiore in questa circostanza è l’assorbimento del molibdeno. In presenza di un pH basso diventa più difficoltoso per la pianta assorbire anche azoto e zolfo. Se il pH diventa veramente troppo basso, si può verificare un’intossicazione. Le piante assorbono facilmente manganese e alluminio in presenza di un pH basso, e sono proprio queste le sostanze che possono provocare l’intossicazione della pianta. Nella figura sottostante viene presentata una breve panoramica di quanto spiegato precedentemente.
| Difficilmente/non assorbibile in presenza di un pH ≤5 | Difficilmente/non assorbibile in presenza di un pH ≥6 |
| Azoto (N) | Boro (B) |
| Molibdeno (Mo) | Fosfati (PO) |
| Zolfo (S) | Rame (Cu) |
Sebbene il pH dell’acqua di irrigazione venga solitamente monitorato, si potrebbe verificare una differenza con il pH del substrato o dell’acqua di drenaggio. Limitando determinati elementi che non riescono ad essere assorbiti dalle piante o che vengono eliminati dalle piante, solitamente il pH dovrebbe abbassarsi. Ciò dipende dalla composizione del substrato. Ogni substrato presenta caratteristiche specifiche in termini di composizione ed equilibrio dell’umidità che può incidere sul pH. Un substrato che presenta un drenaggio minimo registrerà un accumulo di EC, il che spesso si traduce in una riduzione del pH. In questa figura è possibile osservare quali elementi sono più facilmente assorbibili dalle piante in presenza di un determinato pH.
pH nei contenitori di fertilizzanti
Per avere un’ottima solubilizzazione dei fertilizzanti nel contenitore è necessario che il pH non superi il valore di 6. Si consiglia di mantenere il pH tra 4 e 5, in modo che tutto il fertilizzante si possa disciogliere adeguatamente. È inoltre importante che il ferro non venga versato nello stesso contenitore con acido fosforico e acido nitrico. Gli acidi intaccano infatti i chelati di ferro e in tal modo ossidano il ferro. Si creerà un legame tra Fe3+ assimilabile e O2 e il ferro si trasformerà in ferro non assimilabile Fe2O3(ruggine).
Monitoraggio
Quando viene misurato il pH, è importante farlo il più velocemente possibile dopo il prelievo del campione: infatti il pH di un campione d’acqua cambia nel tempo. È importante prelevare un campione di acqua fresca e non di acqua stagnante. Per tali motivi non ha quasi nessuna utilità inviare campioni ai laboratori per eseguire la misurazione del pH.
Si consiglia di pulire regolarmente il piaccametro e di calibrarlo più volte all’anno. Con il passare del tempo è possibile che il dispositivo di misurazione riporti dei valori errati, il che può avere come conseguenza una somministrazione di acqua con pH errato alle piante.
Dispositivo di misurazione manuale
Il sensore di un piaccametro è molto sensibile ed è perciò consigliabile di non toccarlo a mani nude. Le mani nude possono danneggiare il sensore e provocare delle misurazioni inesatte. Dopo ogni misurazione il sensore deve essere pulito. La cosa migliore da fare è sciacquarlo con acqua demineralizzata affinché non rimanga alcuna sostanza dannosa su di esso. È inoltre importante mantenere il sensore umido in modo che nessun’altra sostanza si asciughi sul sensore. A tale scopo si consiglia di versare una soluzione additiva speciale nel tappo del sensore.

Contatore
Se si lavora con un tubo in cui i fertilizzanti delle vasche vengono miscelati solo quando entrano nella serra, è importante che il piaccametro non si trovi troppo vicino al miscelatore. Il piaccametro dovrà trovarsi a 2-3 metri di distanza dal miscelatore perché il pH qui non si è ancora stabilizzato.
Quando si trovano residui sul sensore, questo può essere pulito con un panno morbido, lasciandolo in ammollo per un quarto d’ora in acqua e sapone delicato oppure immergendolo nell’alcol.
Influsso della pianta sul pH
La pianta ha un’influenza molto elevata sul pH dal momento che quest’ultima assorbe in modo selettivo determinati elementi nutritivi. In presenza di un assorbimento uguale di cationi (ioni con carica positiva) e anioni (ioni con carica negativa), il pH del substrato rimarrà invariato. La carica elettrica nella pianta deve rimanere neutra e ciò significa che se la pianta assorbe ad esempio potassio (K+), dovrà rilasciare ioni idrogeno (H+). Viceversa, ciò significa che se la pianta assorbe ad esempio nitrato (NO3–), dovrà rilasciare ioni idrossido (OH–). Quando una pianta assorbe cationi e anioni nella stessa quantità, H+ si legherà con OH– per diventare acqua neutra (H2O). Se non esiste un equilibrio tra questi due, il pH cambierà. Nel momento in cui vengono rilasciati più ioni di idrogeno (H+) il pH si abbasserà mentre se vengono rilasciati più ioni idrossido (OH–) il pH si alzerà.
Poiché le radici respirano, producono anche diossido di carbonio (CO2). In tal modo anche la CO2 reagirà con l’OH–, formando carbonato di idrogeno (HCO3). Se le piante assorbono più cationi di anioni, ciò abbasserà il pH.
Nel momento in cui una pianta entra nella fase generativa, assorbe più potassio (K+), provocando un abbassamento del pH.
L’azoto (N) sotto forma di ammonio viene trasformato in nitrato (NO3–). In tal modo la concentrazione di idrogeno (H+) nel substrato aumenterà e di conseguenza il pH si abbasserà. È quindi importante che quando viene somministrato molto ammonio, il pH della concentrazione sia sufficientemente alto. Ciò significa che in estate deve essere superiore a 5,5 e in inverno può essere leggermente inferiore poiché viene utilizzato meno azoto per le piante. È consigliabile abbassarlo con ammonio.
Tamponare il substrato
Il pH può venire tamponato nel substrato mediante l’aggiunta ad esempio di Dolokal (CaCO3 + MgO). Quando il Dolokal viene aggiunto nel substrato, si scioglierà lentamente. Mentre il Dolokal si scioglie, vengono liberati degli elementi. Tali elementi influiscono sul pH, che si alzerà. Solitamente il Dolokal contiene il 5% di ossido di magnesio (MgO), ma è disponibile anche un Dolokal extra che contiene MgO al 10%. La reazione nel terreno del gruppo carbonato del Dolokal è la seguente:
CO32- à H+ + CO32- à HCO3–
HCO3– à H+ + HCO3– à H2O + CO2
Il bicarbonato (HCO3) è un elemento che non offre molto alle piante in termini di nutrienti, tuttavia riveste una funzione importante per il pH nel substrato. Quanto più elevato è il valore dell’ HCO3, tanto superiore sarà il valore del pH nel substrato. Nei substrati di tipo calcareo è difficile drenare l’HCO3 mentre nei substrati più leggeri come il bark è più facile.
Il tamponamento del bicarbonato viene espresso dalla seguente formula:
H2O + H+ à H3O + HCO3 à H2CO3 + H2O à 2H2O + CO2
È possibile osservare che il bicarbonato si unisce all’ H3O per essere trasformato infine in acqua (H2O) e anidride carbonica (CO2).
Spesso la soluzione nutritiva viene tamponata con calcio e ciò può avvenire in due modi: bicarbonato di calcio (K2CO3) o una soluzione di idrossido di potassio (KOH). Il bicarbonato di calcio è ad azione lenta per cui l’effetto non sarà immediatamente misurabile. L’idrossido di potassio possiede invece un’azione diretta di innalzamento del pH.
Anche il fosfato possiede un’azione tampone e può tamponare in diverse composizioni. Gli ioni fosfato che consentono di tamponare sono i seguenti:
PO43−, HPO42−, H2PO4− e H3PO4
È qui possibile osservare che il fosfato possiede una tripla azione tampone.
Osservazione
Con il ferro la solubilità dipende dal tipo di chelato fornito. Vi sono tre diversi chelati che risultano stabili in presenza di diversi valori di pH. Il legame meno stabile è l’EDTA mentre il legame più stabile è l’EDDHA. Di seguito viene riportato uno schema con i valori del pH in cui i chelati sono stabili.
| Tipo di chelato | Stabile con pH |
| EDTA | 3 – 6 |
| DTPA | 3 – 6,5 |
| EDDHA | 3 – 10 |
Quando il chelato di ferro non è stabile, si disintegra e il ferro non viene sciolto. In tal modo il ferro si trasforma da Fe2+ (sciolto) in Fe3+ (ruggine). Per tale motivo è importante scegliere il tipo giusto di chelato. Quando il ferro viene liberato dal chelato si crea immediatamente un legame mediante il quale il precipitato diviene ferro che non sarà più assimilabile dalle piante. Quanto più forte è il legame tanto più costoso diventa il ferro e questo perché di conseguenza il processo di produzione di questi chelati diviene anch’esso più caro.
pH nella Phalaenopsis
Con le Phalaenopsis è importante sapere che il pH nel vaso può abbassarsi nel corso della coltivazione. In frigorifero durante l’induzione fiorale e durante il resto della crescita degli steli, la Phalaenopsis assorbirà più calcio e ciò provocherà un abbassamento del pH nel substrato.
In inverno la Phalaenopsis utilizza meno azoto che in estate. Ciò significa che il pH può essere leggermente inferiore, considerato che la pianta riceve sufficiente azoto.

pH e Anthurium da reciso
Oltre all’influenza che la pianta di Anthurium da reciso ha sul pH, l’acidità viene definita soprattutto dal substrato in cui viene coltivata. Con la lana di roccia il pH resta alto a lungo, mentre con la perlite già dopo 6 mesi di coltivazione il pH può abbassarsi fortemente nell’acqua di drenaggio. Il comportamento dell’oasis dipende fortemente dalla misura in cui viene sottoposto a calcinazione. La calcinazione con Dolokal/Dolomiet è necessaria solitamente ogni anno per le coltivazioni con oasis. Nella coltivazione con perlite è possibile mantenere a 3,0 il pH nel tubo di drenaggio mediante la giusta concentrazione di pH e quantità di bicarbonato (HCO3-) nell’acqua.
La varietà può influire enormemente sul pH del substrato o nel tubo di drenaggio. A causa dell’assorbimento selettivo degli elementi è possibile osservare che nelle varietà leggere (Moments®, Acropolis® e Angel®) il pH si può abbassare rapidamente e raggiungere livelli molto bassi. Livelli di pH pari a 2,0 non rappresentano quindi un’eccezione. A causa del pH basso, l’assorbimento di Ca2+ viene fortemente ostacolato e ciò causa un peggiore sviluppo delle strutture delle cellule. In questi casi si possono facilmente verificarsi problemi di vetrosità o di scolorimento della brattea.

Un fiore vetroso è causato da un pH troppo basso.
Il pH è di enorme importanza per la pianta, ed è perciò sempre consigliabile tenere sotto controllo il pH della soluzione nutritiva utilizzata per le piante. In caso di domande su questo argomento o su altri elementi tecnici della coltivazione, è possibile contattare Bureau IMAC Bleiswijk.





