Además de controlar cuidadosamente los nutrientes y la CE (conductividad eléctrica) suministrados a las plantas, también prestamos mucha atención al pH del agua de alimentación. ¿Por qué hacemos esto? ¿Por qué es tan importante el pH y cuál es su influencia en la planta?
El valor del pH representa el logaritmo negativo de la concentración de iones de hidrógeno en una solución. El pH es, por tanto, una medida de la acidez. Aumentar o disminuir un punto el pH implica que la solución se vuelva diez veces más alcalina o ácida, respectivamente. Dicho de otro modo, cada punto multiplica o divide por diez la concentración, por lo que, por ejemplo, un pH 4 es 1.000 veces más ácido que un pH 7. Por eso el pH juega un papel tan importante en nuestros cultivos. Un agua demasiado ácida ejerce un impacto negativo sobre la planta y su entorno radicular. Este artículo tratará más adelante este aspecto.

El pH en el riego
Hay un determinado pH estándar en el sustrato de las plantas. Para un buen sistema radicular, es importante que el pH del sustrato y el de la raíz no difieran en exceso. Es deseable que, al regar, los valores de pH del sustrato y de la raíz varíen lo menos posible. Esta estabilidad ayudará a que la planta absorba mejor sus nutrientes.
Absorción de nutrientes por la planta
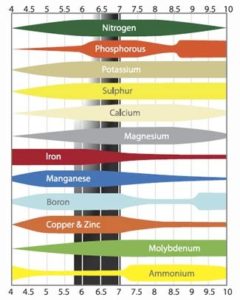
El pH influye de modo notorio en la absorción de nutrientes por la raíz. Con un valor demasiado alto o bajo, los nutrientes se asimilan de forma óptima. Para las plantas, el pH ideal de una solución de nutrientes se mueve en la franja entre 5 y 6. Cuando el pH es superior a 6, se dificulta la absorción de boro, cobre y fosfatos. Las sustancias también precipitan antes con un pH elevado, lo que podría suceder tanto en el tanque del abono como en la red de tuberías.
Cuando el pH desciende en exceso, es decir, por debajo de 5, la planta tiene problemas para capturar otro tipo de sustancias. El principal obstáculo se da en la absorción de molibdeno, pero con un pH bajo también se obstaculiza la asimilación de nitrógeno y azufre. A valores escasos de pH puede producirse una intoxicación por manganeso y aluminio, debido a que la planta los absorbe con mayor facilidad. La siguiente tabla resume lo expuesto hasta ahora:
| Difícil o imposible de absorber a pH ≤5 | Difícil o imposible de absorber a pH ≥6 |
| Nitrógeno (N) | Boro (B) |
| Molibdeno (Mo) | Fosfatos (PO) |
| Azufre (S) | Cobre (Cu) |
Aunque suele controlarse el pH del agua de riego, puede diferir de aquel del sustrato o drenaje. La acumulación de ciertos elementos excretados o no absorbidos por las plantas suele causar una disminución del pH, un hecho vinculado a la composición del sustrato. Cada sustrato presenta propiedades diversas en lo tocante al equilibrio hídrico, lo cual influye en el pH. Un sustrato con drenaje escaso acumula CE, lo que a menudo comporta el descenso del pH.
A certain pH is standard in the substrate of the plants. For a good root system, it is important that the pH of the substrate and the root are not too far apart. When watering, you want to change the pH value of the substrate and the root as little as possible. By keeping this stable, the plant will be able the best to absorb nutrients.
Esta gráfica muestra el pH al que las plantas absorben mejor cada elemento.
El pH en los tanques del abono
Para disolver los fertilizantes en el tanque del abono, el pH no debe ser superior a 6 Nuestro consejo es mantener un pH de entre 5 y 5 para una disolución correcta. También es primordial no introducir el hierro en el mismo recipiente que los ácidos fosfórico y nítrico. Los ácidos corroen los quelatos de hierro, por lo que el hierro se oxida y el Fe3+ absorbible se une al O2 para convertirse en Fe2O3 no absorbible (óxido).
Monitorización
A la hora de medir el pH, es básico hacerlo justo después de tomar la muestra de agua, ya que este parámetro varía con el tiempo. Para la muestra, es fundamental tomar agua fresca y no vieja y estancada. Por estas razones, es poco o nada útil enviar muestras a los laboratorios para la medición del pH.
Limpie el pH-metro con regularidad y calíbrelo varias veces al año. Con el tiempo, es posible que el equipo de medición indique valores incorrectos, por lo que las plantas podrían acabar recibiendo agua con un pH incorrecto.
Medidor manual
El sensor de un pH-metro es muy sensible, por lo que es mejor no tocarlo con las manos sin protección. Una mano descubierta puede dañarlo, con el resultado de mediciones incorrectas. El sensor debe limpiarse después de cada medición. Lo mejor es enjuagarlo con agua desmineralizada para que no quede ninguna sustancia nociva. También es importante almacenar el sensor en un ambiente húmedo para evitar que acumule residuos secos. Para ello hay que colocar un líquido especial de almacenamiento en la tapa del sensor.
.

Unit contador
Cuando se trabaja con una frecuencia de administración en la que los fertilizantes procedentes de los contenedores se mezclan solamente al entrar en el invernadero, es primordial que el pH-metro no esté demasiado cerca del aparato mezclador, sino a unos dos o tres metros, ya que aquí el pH aún no se ha estabilizado.
La suciedad en el sensor puede eliminarse con un paño suave, sumergiéndolo en agua ligeramente jabonosa durante 15 minutos o en alcohol.
Influencia de la planta en el pH
La propia planta ejerce una gran influencia en el pH porque absorbe determinadosnutrientes de modo selectivo. Si los cationes (iones con carga positiva) y los aniones (iones con carga negativa) se absorben por igual, el pH del sustrato no variará. La carga eléctrica de la planta debe permanecer neutra; esto significa que, por ejemplo, si la planta absorbe potasio (K+), dejará de usar hidrógeno (H+). Por el contrario, también quiere decir que si, por ejemplo, la planta absorbe nitrato (NO3–), dejará de usar hidróxido (OH–). Cuando la planta absorbe la misma cantidad de cationes y aniones, el H+ se une al OH– y se obtiene agua con carga neutra (H2O). Si no hay equilibrio entre ambos variará el pH. A medida que se liberan más iones de hidrógeno (H+), el pH disminuye, y a medida que se liberan más iones de hidróxido (OH–), el pH aumenta.
Puesto que las raíces respiran, también producen dióxido de carbono (CO2). Como resultado, el CO2 también reaccionará con el OH– y se generará carbonato de hidrógeno (HCO3). Las plantas absorben más cationes que aniones, lo que causa el descenso del pH.
Cuando una planta se vuelve generativa, absorbe más potasio (K+) y el pH disminuye.
El nitrógeno (N) en forma de amonio se convierte en nitrato (NO3–). Esto hace que la concentración de hidrógeno (H+) en el sustrato aumente y resulte en un pH más bajo. Por lo tanto, es importante que el pH de los aportes sea lo suficientemente alto cuando se administra una gran cantidad de amonio. Esto significa que debe ser superior a 5,5 en verano y ligeramente inferior en invierno, cuando las plantas utilizan menos nitrógeno. Es buena idea reducirlo con amonio.
Tamponamiento del sustrato
El pH se puede tamponar en el sustrato, por ejemplo, mezclando con Dolokal (CaCO3 + MgO), que es de disolución lenta. A medida que el Dolokal se disuelve se van liberando los elementos. Estos elementos influyen en el pH, que acabará aumentando. Habitualmente, el Dolokal contiene un 5% de óxido de magnesio (MgO), pero también existe un Dolokal Extra al 10%. La reacción en el suelo del grupo de carbonatos del Dolokal es la siguiente:
CO32- à H+ + CO32- à HCO3–
HCO3– à H+ + HCO3– à H2O + CO2
El bicarbonato (HCO3) es un compuesto que no aporta mucho a las plantas en términos de nutrición, pero sí ejerce una función importante en cuanto al pH del sustrato. Cuanto mayor es el valor de HCO3, más alto es el pH en el sustrato. En sustratos arcillosos, es difícil enjuagar el HCO3, mientras que en sustratos aireados como la corteza es más fácil.
La fórmula del tamponamiento del bicarbonato se expresa de la siguiente manera:
H2O + H+ à H3O + HCO3 à H2CO3 + H2O à 2H2O + CO2
En ella se observa que el bicarbonato se une al H3O para convertirse finalmente en agua (H2O) y dióxido de carbono (CO2).
El agua de alimentación se tampona a menudo con potasio de dos formas posibles: bicarbonato de potasio (K2CO3) e hidróxido de potasio (potasa cáustica) (KOH). El bicarbonato de potasio es de acción lenta, por lo que su impacto no se puede medir directamente. En cambio, la potasa cáustica produce un aumento directo del pH.
El fosfato también ejerce un efecto tamponador y puede utilizarse en composiciones distintas. Los compuestos de fosfato que tamponan son los siguientes:
PO43−, HPO42−, H2PO4− and H3PO4
Se observa que el fosfato posee un triple efecto tamponador.
Observaciones
La solubilidad del hierro depende del tipo de quelato administrado. Hay tres quelatos diferentes que son estables a diferentes valores de pH. La estructura menos estable es el EDTA y la de mayor estabilidad, el EDDHA. El diagrama siguiente muestra los valores de pH a los que los quelatos son estables.
| Tipo de quelato | PH al cual es estable |
| EDTA | 3 – 6 |
| DTPA | 3 – 6,5 |
| EDDHA | 3 – 10 |
Si el quelato de hierro no es estable, se descompondrá y el hierro no permanecerá disuelto. Así, es seguro que el hierro pasará de Fe2+ (disuelto) a Fe3+ (oxidado). Por ello es fundamental elegir el tipo correcto de quelato. Cuando el hierro se disocia del quelato, de inmediato se forma un enlace y se convierte en hierro precipitado, que ya no es absorbible por las plantas. Cuanto más fuerte es el compuesto, más caro se vuelve el hierro, porque el proceso de producción de estos quelatos se encarece.
El pH en la Phalaenopsis
En el caso de la Phalaenopsis, es importante saber que el pH de la maceta disminuirá durante el cultivo. Durante la fase de vernalización en la inducción de las varas florales y el resto del crecimiento de las varas, la Phalaenopsis absorberá más potasio, lo cual provocará el descenso del pH en el sustrato.
La Phalaenopsis utiliza menos nitrógeno en invierno que en verano. Esto significa que el pH puede ser ligeramente inferior, porque la planta recibe suficiente nitrógeno.

El pH y los anturios de flor cortada
Además de la influencia del propio anturio de flor cortada en el pH, la acidez viene determinada principalmente por el sustrato en el que se cultiva. Con lana de roca, el pH se mantiene alto durante mucho tiempo, mientras que con perlita el pH en el drenaje puede descender considerablemente después de tan solo seis meses de cultivo. El comportamiento del oasis depende en gran medida del grado de encalado. El encalado anual con Dolokal/Dolomita es a menudo necesario para el cultivo en oasis. Cuando se cultiva en perlita, el pH en el drenaje se puede mantener en 3,0 usando la cantidad correcta de bicarbonato (HCO3-) en el agua.
La variedad puede ejercer una gran influencia en el pH del sustrato o drenaje. Debido a la absorción selectiva de elementos, puede observarse que en las especies delicadas (Moments®, Acropolis® y Angel®) el pH puede descender rápidamente y alcanzar niveles muy bajos. No es raro hallar valores de pH de 2,0. Estos valores tan bajos de pH dificultan la absorción de Ca2+, por lo que se entorpece el desarrollo de las estructuras celulares. Entonces se favorece la aparición de alteraciones como la vidriosidad o el viraje a un color azulado en las brácteas.

Flor vidriada causado por un pH bajo
El grado de pH es vital para la planta, por lo que siempre hay que estar atento a este parámetro tanto en la solución nutritiva como en todo aquello que se le suministre. Para cualquier cuestión sobre este tema u otros aspectos técnicos del cultivo, puede ponerse en contacto con Bureau IMAC Bleiswijk.







